อะตอม ธาตุ และสารประกอบ
อะตอม คือหน่วยพื้นฐานของสสารประกอบด้วยส่วนของนิวเคลียสที่หนาแน่นมากอยู่ตรงศูนย์กลาง ล้อมรอบด้วยกลุ่มหมอกของอิเล็กตรอนที่มีประจุลบ นิวเคลียสของอะตอมประกอบด้วยโปรตอนที่มีประจุบวกกับนิวตรอนซึ่งเป็นกลางทางไฟฟ้า (ยกเว้นในกรณีของ ไฮโดรเจน-1 ซึ่งเป็นนิวไคลด์ชนิดเดียวที่เสถียรโดยไม่มีนิวตรอนเลย) อิเล็กตรอนของอะตอมถูกดึงดูดอยู่กับนิวเคลียสด้วยแรงแม่เหล็กไฟฟ้า ในทำนองเดียวกัน กลุ่มของอะตอมสามารถดึงดูดกันและกันก่อตัวเป็นโมเลกุลได้ อะตอมที่มีจำนวนโปรตอนและอิเล็กตรอนเท่ากันจะมีสภาพเป็นกลางทางไฟฟ้า มิฉะนั้นแล้วมันอาจมีประจุเป็นบวก (เพราะขาดอิเล็กตรอน) หรือลบ (เพราะมีอิเล็กตรอนเกิน) ซึ่งเรียกว่า ไอออน เราจัดประเภทของอะตอมด้วยจำนวนโปรตอนและนิวตรอนที่อยู่ในนิวเคลียส จำนวนโปรตอนเป็นตัวบ่งบอกชนิดของธาตุเคมี และจำนวนนิวตรอนบ่งบอกชนิดไอโซโทปของธาตุนั้น

ที่มา https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEilXkGChwblIpndJiFKhRcPynre4gWicdjf-7d7tKgrewGU84rdt9Ib2Bf0P4QhVnUkpcdycovjVIESU9aEC59DANGOTqgKH1-do_Fkenuc8ji8PtWApja8TlaAs1d_Za3p5KSCdYraFLA/s1600/picture0.gif
ธาตุ (Element) หมายถึง สารบริสุทธิ์เนื้อเดียวที่มีองค์ประกอบอะตอมของธาตุเพียงชนิดเดียวเท่านั้น ธาตุไม่สามารถจะนำมาแยกสลายให้กลายเป็นสารอื่นโดยวิธีการทางเคมี แต่อาจแยกออกโดยวิธีนิวเคลียร์
ธาตุเป็นองค์ประกอบหลักของสารทุกชนิด ธาตุเกือบทุกชนิดนักวิทยาศาสตร์ได้ศึกษาคันพบแล้ว ปัจจุบันมีการค้นพบธาตุแล้วไม่ต่ำกว่า 119 ธาตุ เป็นธาตุที่อยู่ในธรรมชาติ 89 ธาตุ ที่เหลือเป็นธาตุที่สังเคราะห์ขึ้น ธาตุบางธาตุอาจค้นพบแล้ว แต่ไม่มีการเปิดเผยเพราะเป็นประโยชน์ทางธุรกิจ
พันธะเคมี
1. พันธะไอออนิก (Ionic bond)
- เกิดจากอะตอม 2 อะตอมขึ้นไปให้และรับอิเล็กตรอนกัน
- ตัวให้อิเลกตรอนเรียกว่า ตัวรีดิวซ์ (reducing agent) ตัวรับอิเลกตรอนเรียกว่า ตัวออกซิไดซ์ (oxidizing agent)
- มักเกิดขึ้นระหว่างโลหะกับอโลหะ
- โลหะเมื่อให้อิเล็กตรอนจะมีประจุบวก
- อโลหะเมื่อที่รับอิเล็กตรอนจะมีประจุลบ
- ไอออนที่มีประจุตรงกันข้ามกันจะดึงดูดกันทำให้เกิดพันธะไอออน
- มีความแข็งแรงมากกว่าพันธะไฮโดรเจน แข็งแรงพอๆ กับพันธะโคเวเลนต์
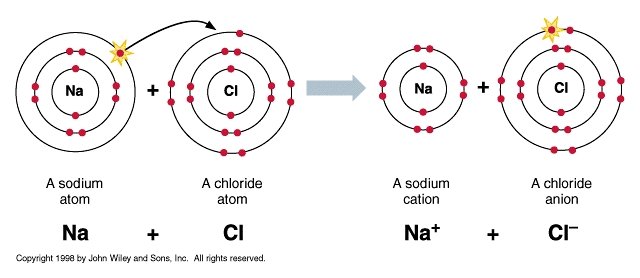
รูปที่ 1. พันธะไอออนิค (ionic bond) เกิดจากการให้เเละรับอิเลกตรอนระหว่างตัวรีดิวซ์เเละตัวออกซิไดซ์ เช่น NaCl เกิดจากอะตอมของ Na ให้electron แก่ Cl กลายเป็น Na+ (reducing agent) ขณะที่ Cl กลายเป็น Cl- (oxidizing agent) ส่งผลให้ electron วงนอกของอะตอม Na และ Cl ครบ 8 กลายเป็นสารประกอบ NaCl
2. พันธะโควาเลนต์ (Covalenะ bond)
- เกิดจากอะตอม 2 อะตอมมีการใช้อิเลกตรอนวงนอกสุดหรือ valence electron ร่วมกันเพื่อ เพื่อให้valence electron ครบ 8 ตามกฎ octet (ยกเว้นไฮโดรเจนที่ครบ 2)
- อะตอมที่เกิดพันธะดังกล่าวจะมีวาเลนซ์อิเล็กตรอนอยู่มากเช่น ธาตุหมู่ VI และหมู่ VII
- พันธะโควาเลนต์แข็งแรงกว่าพันธะไฮโดรเจน และมีความแข็งแรงพอๆ กับพันธะไอออนิก
- มักเกิดขึ้นระหว่างอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีใกล้เคียงกัน
- ธาตุอโลหะมีแนวโน้มที่จะสร้างพันธะโควาเลนต์มากกว่าธาตุโลหะซึ่งมักสร้างพันธะโลหะ
- อิเล็กตรอนของธาตุโลหะสามารถเคลื่อนอย่างอิสระส่วนอิเล็กตรอนของธาตุอโลหะไม่สามารถเคลื่อนที่ได้อย่างอิสระนัก การใช้อิเล็กตรอนร่วมกันจึงเป็นทางเลือกเดียวในการสร้างพันธะกับธาตุที่มีสมบัติคล้ายๆ กัน
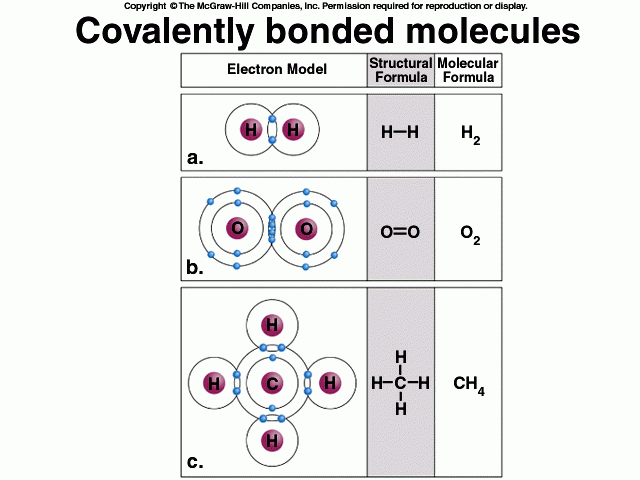
รูปที่ 2. Covalent bond เป็นพันธะที่เกิดจากการใช้ electron ร่วมกันของ 2 อะตอม เช่น ก๊าซไฮโดรเจน (H2) ออกซิเจน (O2) น้ำ (H2O) และมีเทน (CH4) เป็นต้น โดยการเเชร์อิเลกตรอนรวมกัน 1 คู่จะเเสดงแขนพันธะ 1 เเขน
พันธะโควาเลนต์เเบ่งออกได้เป็น 2 แบบ (ตามรูปที่ 3)
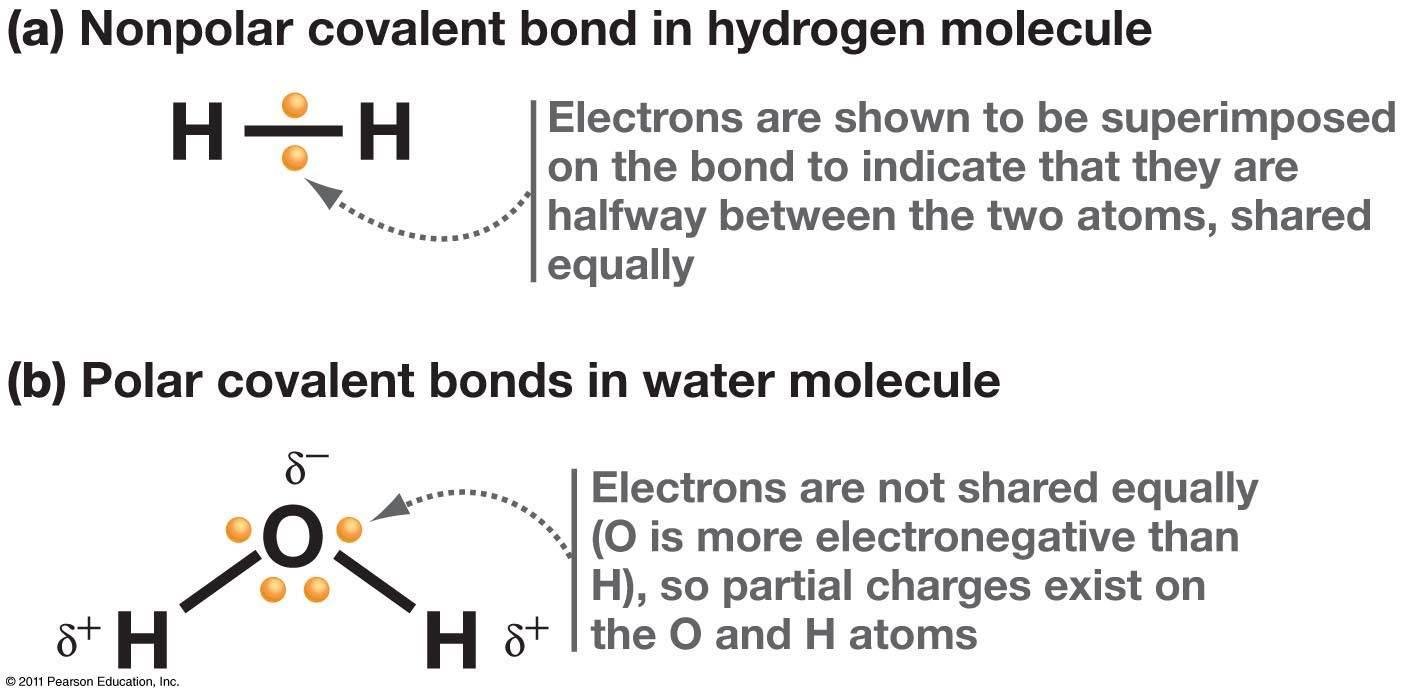
รูปที่ 3. เเสดงการมีขั้วกับไม่มีขัวของพันธะโควาเลนต์
- nonpolar covalent เป็นการใช้อิเล็กตรอนร่วมกัน โดยอิเล็กตรอนวิ่งรอบอะตอมทั้งสองเท่ากัน เช่น H2 ,O2 และ CH4
- polar covalent เป็นการใช้อิเล็กตรอนร่วมกันโดยอะตอมที่มี electronegativity สูง จะดึงอิเล็กตรอนมาใกล้ตัวมากกว่า จึงทำให้มีประจุ เช่น H2O โดย O มีค่า EN. สูงสามารถดึงอิเล็กตรอนเข้ามาวน รอบตัวเองได้มากกว่า H จึงทำให้ O เป็นลบ H เป็นบวก
3. พันธะไฮโดรเจน (HYDROGEN BOND)
- เป็นพันธะระหว่างโมเลกุลที่แข็งแรงมากกว่าพันธะระหว่างโมเลกุลเเบบอื่นๆ (ย้ำนะครับมันไม่ใช่พันธะภายในนะจึงเเข็งเเรงไม่เท่าพันธะโควาเลนต์เเละพันะธะไอออนิก เห็นมักจะเข้าใจผิดกันบ่อย)
- เกิดจากไฮโดรเจนกับธาตุที่มีค่าอิเล็กโตรเนกาติวิตีสูง ได้แก่ ออกซิเจน (O) ฟลูออรีน (F) และไนโตรเจน (N)
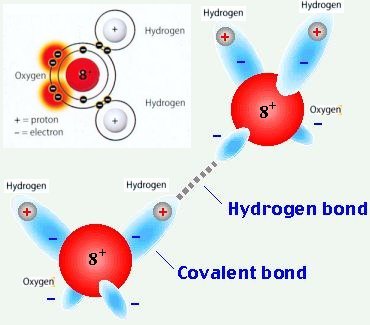
รูปที่ 4. แสดงพันธะไฮโดรเจนระหว่างโมเลกุลของน้ำ เเต่หากเป็นไฮโดรเจนที่จับกับออกซิเจนภายในดมเลกุลจะเป็นพันธะโควาเลนต์
ไม่มีความคิดเห็น:
แสดงความคิดเห็น